Prion protein PrP/CD230 Polyklonaler Antikörper
Prion protein PrP/CD230 Polyklonal Antikörper für WB, IHC, IP, ELISA
Wirt / Isotyp
Kaninchen / IgG
Getestete Reaktivität
human, Maus, Ratte
Anwendung
WB, IHC, IP, CoIP, ELISA
Konjugation
Unkonjugiert
Kat-Nr. : 12555-1-AP
Synonyme
Geprüfte Anwendungen
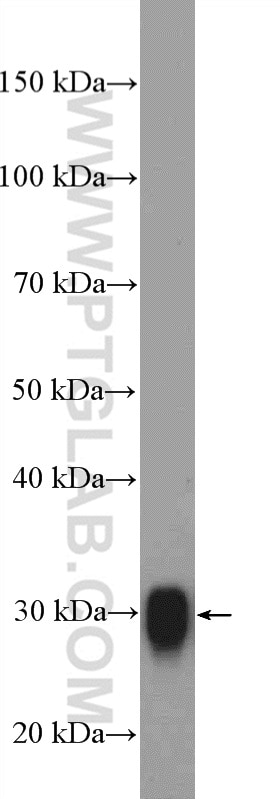
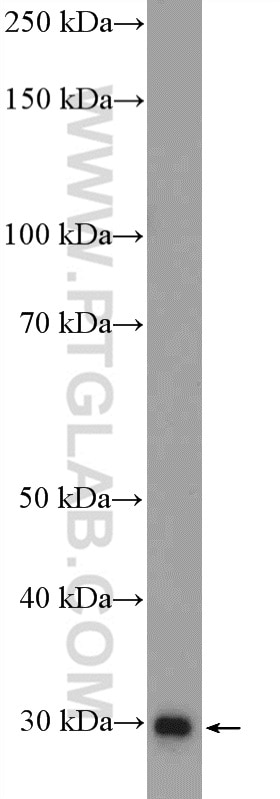
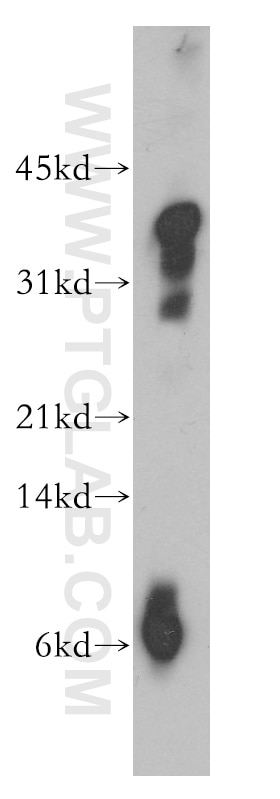
| Erfolgreiche Detektion in WB | Maushirngewebe, humanes Hirngewebe, Rattenhirngewebe |
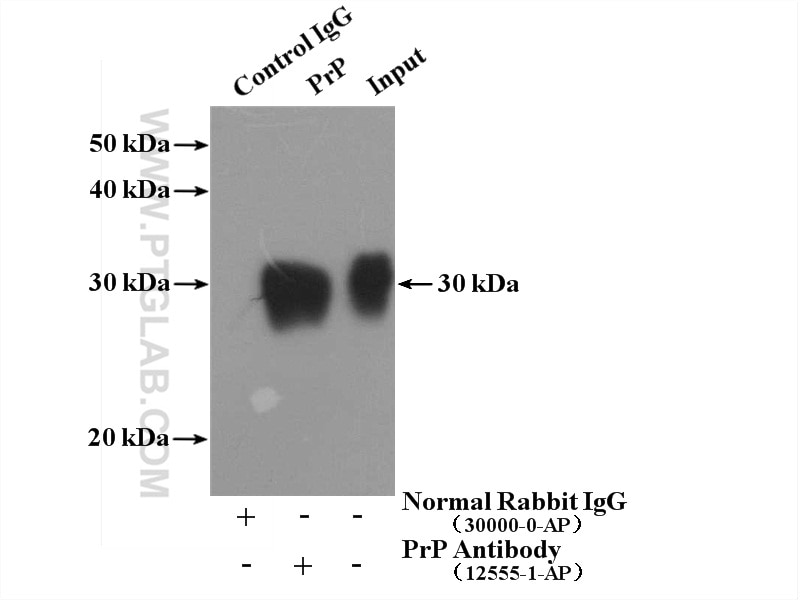
| Erfolgreiche IP | Maushirngewebe |
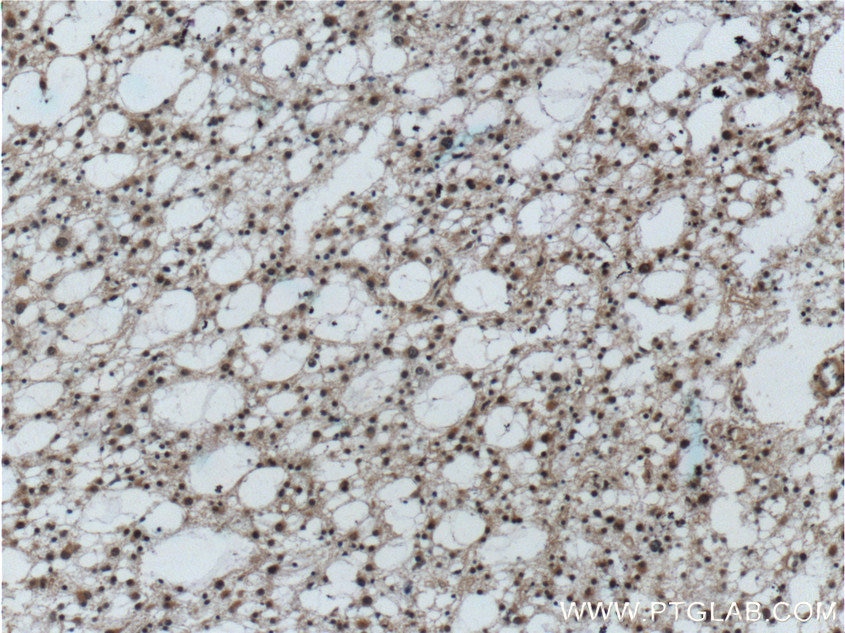
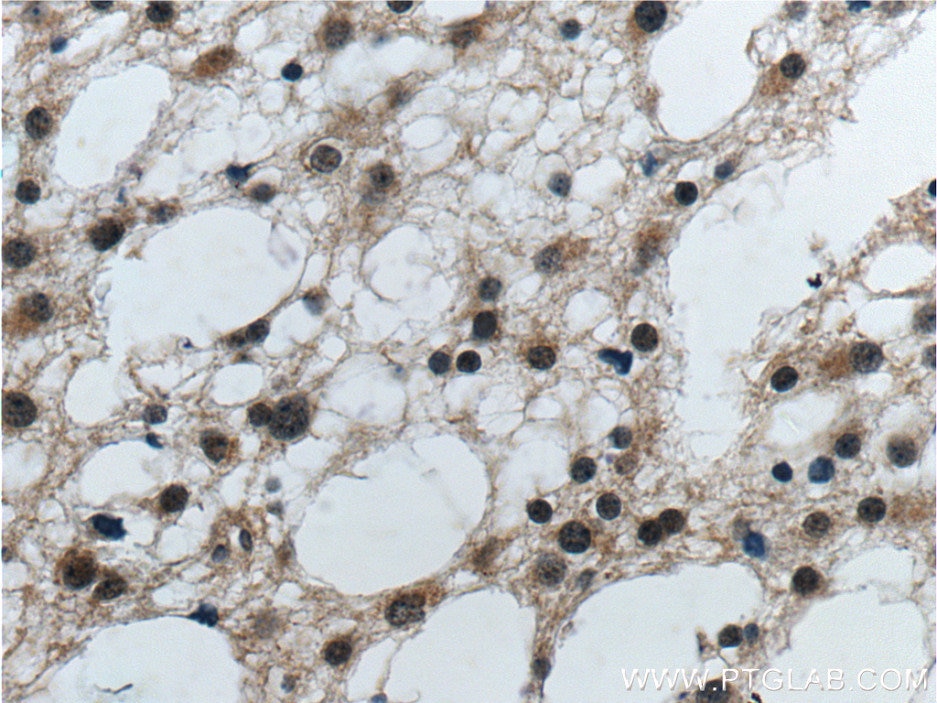
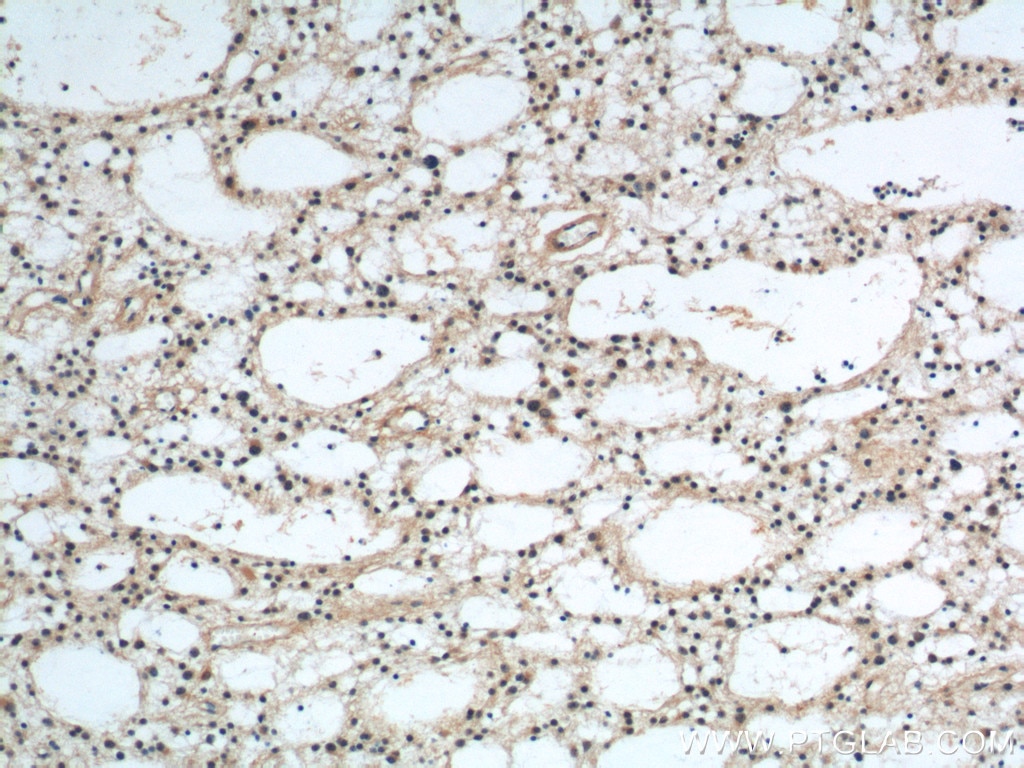
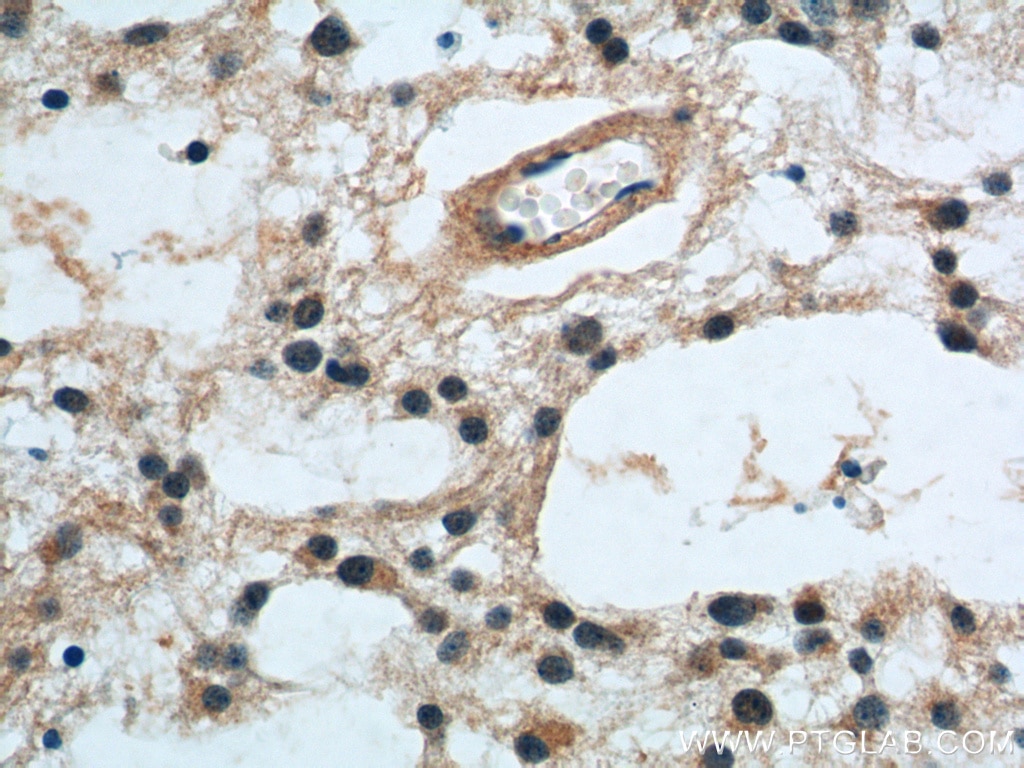
| Erfolgreiche Detektion in IHC | humanes Gliomgewebe Hinweis: Antigendemaskierung mit TE-Puffer pH 9,0 empfohlen. (*) Wahlweise kann die Antigendemaskierung auch mit Citratpuffer pH 6,0 erfolgen. |
Empfohlene Verdünnung
| Anwendung | Verdünnung |
|---|---|
| Western Blot (WB) | WB : 1:500-1:2000 |
| Immunpräzipitation (IP) | IP : 0.5-4.0 ug for 1.0-3.0 mg of total protein lysate |
| Immunhistochemie (IHC) | IHC : 1:20-1:200 |
| It is recommended that this reagent should be titrated in each testing system to obtain optimal results. | |
| Sample-dependent, check data in validation data gallery | |
Veröffentlichte Anwendungen
| WB | See 8 publications below |
| IHC | See 2 publications below |
| IP | See 1 publications below |
| CoIP | See 1 publications below |
Produktinformation
12555-1-AP bindet in WB, IHC, IP, CoIP, ELISA Prion protein PrP/CD230 und zeigt Reaktivität mit human, Maus, Ratten
| Getestete Reaktivität | human, Maus, Ratte |
| In Publikationen genannte Reaktivität | human, Maus, Ratte |
| Wirt / Isotyp | Kaninchen / IgG |
| Klonalität | Polyklonal |
| Typ | Antikörper |
| Immunogen | Prion protein PrP/CD230 fusion protein Ag3257 |
| Vollständiger Name | prion protein |
| Berechnetes Molekulargewicht | 34 kDa |
| Beobachtetes Molekulargewicht | 30 kDa |
| GenBank-Zugangsnummer | BC022532 |
| Gene symbol | PrP |
| Gene ID (NCBI) | 5621 |
| Konjugation | Unkonjugiert |
| Form | Liquid |
| Reinigungsmethode | Antigen-Affinitätsreinigung |
| Lagerungspuffer | PBS with 0.02% sodium azide and 50% glycerol |
| Lagerungsbedingungen | Bei -20°C lagern. Nach dem Versand ein Jahr lang stabil Aliquotieren ist bei -20oC Lagerung nicht notwendig. 20ul Größen enthalten 0,1% BSA. |
Hintergrundinformationen
Prion protein (PRNP) is a ubiquitous membrane glycoprotein whose abnormal self-replicating, misfolded form is widely believed to cause several central nervous system disorders, collectively known as Transmissible Spongiform Encephalopathies (TSE). Prion diseases are TSEs, attributed to conformational conversion of the cellular prion protein (PrPC) into an abnormal conformer that accumulates in the brain. The two isoforms, PrPC and PrPS, have the same primary amino acid sequence and only differ in conformation. While PrPC is composed of 42% α-helix and only 3% β-sheet, PrPSc is composed of 30% α-helix and 43% β-sheet. PrPC converts to its pathogenic isoform when the region corresponding to the residues 108-144 fold into β-sheets. PrPC is very soluble in detergents and easily digested by proteases while the PrPSc is insoluble in detergents and resistant to protease digestion. Prion diseases exist in infectious, sporadic, and genetic forms.
Protokolle
| PRODUKTSPEZIFISCHE PROTOKOLLE | |
|---|---|
| WB protocol for Prion protein PrP/CD230 antibody 12555-1-AP | Protokoll herunterladen |
| IHC protocol for Prion protein PrP/CD230 antibody 12555-1-AP | Protokoll herunterladenl |
| IP protocol for Prion protein PrP/CD230 antibody 12555-1-AP | Protokoll herunterladen |
| STANDARD-PROTOKOLLE | |
|---|---|
| Klicken Sie hier, um unsere Standardprotokolle anzuzeigen |
Publikationen
| Species | Application | Title |
|---|---|---|
Neuron Muskelin Coordinates PrPC Lysosome versus Exosome Targeting and Impacts Prion Disease Progression. | ||
PLoS Biol TMED9 coordinates the clearance of misfolded GPI-anchored proteins out of the ER and into the Golgi | ||
Front Mol Biosci Single-cell transcriptomics uncover the key ferroptosis regulators contribute to cancer progression in head and neck squamous cell carcinoma | ||
PLoS One Copper homeostasis-associated gene PRNP regulates ferroptosis and immune infiltration in breast cancer | ||
Mol Carcinog Inhibition of the RBMS1/PRNP axis improves ferroptosis resistance-mediated oxaliplatin chemoresistance in colorectal cancer | ||
Front Cell Dev Biol PRNP is a pan-cancer prognostic and immunity-related to EMT in colorectal cancer |