Western-Blot-Protokoll
Jump to:
- Western-Blot-Protokoll
- Wie SIe Ihr Western Blot optimieren
- SDS-PAGE Gel Rezepte
- So optimieren Sie Ihre Ergebnisse mit Proteinen mit niedrigem Molekulargewicht
- Tricine Gel Rezept für Proteine mit niedrigem Molekulargewicht
- Wahl des richtigen Lysepuffers
- Problembehandlung: Hoher Hintergrund
- Problembehandlung: schwaches / kein Signal und andere
SDS-PAGE
-
Stellen Sie ein SDS-PAGE-Gel entsprechend dem Molekulargewicht (MW) Ihrer Zielproteine her. (Rezepte finden Sie im Abschnitt "SDS-PAGE-Gelrezepte")
-
Bereiten Sie Proben im Mikrozentrifugenröhrchen vor. Fügen Sie vier Mal Probenpuffer hinzu, so dass die Gesamtproteinmenge etwa 30 - 50 ug je Probe beträgt (entsprechend der Proteinmenge, die durch den Bradford- oder BCA-Test gemessen wird).
-
Flicken Sie die Mikrozentrifugenröhrchen um die Proben zu mischen, drehen Sie sie kurz und erwärmen Sie sie anschließend 5 Minuten lang auf 95 - 100 ° C.
-
Stellen Sie das Elektrophorese-Gerät auf und tauchen Sie es ein Mal in den Laufpuffer ein. Entfernen Sie die Gelkämme und reinigen Sie die Kavitäten von restlichem Stapelgel, indem Sie den Laufpuffer in jeder Vertiefung mit einer Gelfüllspitze auf und ab pipettieren (Abbildung 1).
-
Legen Sie Proben und geeignete Proteinmarker mit einer Spitze auf das Gel.
-
Setzen Sie den Deckel auf den Geltank. Schalten Sie das Elektrophorese-Gerät an und stellen Sie es auf eine niedrige Spannung ein (wenn die Probe durch das Sammelgel läuft), wobei es auf eine höhere Spannung (z.B. 120 V) ansteigt, wenn die Farbstofffront die Trennschicht erreicht. Stoppen Sie das Gel, wenn die Farbstofffront in die gewünschte Position wandert.
| Tipp: Tris-Tricine-Gele separieren Proteine mit niedrigem Molekulargewicht (<20 kDa) besser als Tris-Glycin-Gele. |
Membranübertragung
Bitte beachten Sie: Es werden PVDF-Membrane (oder PSQ-Membrane mit 0,22 μm Mikroporen für Targets <30 kDa) empfohlen.
-
Weichen Sie die Membrane 30 Sekunden lang in Methanol ein, bevor Sie sie in den Transferpuffer übertragen.
-
Tränken Sie die Filterpapiere und Schwämme im Transferpuffer.
-
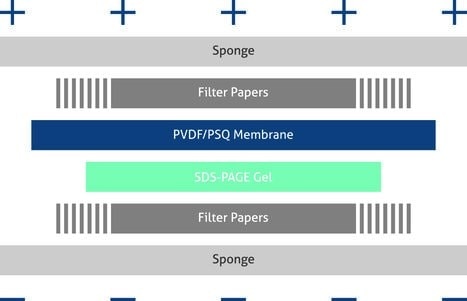
Setzen Sie die Übertragungsbestandteile nacheinander gemäß der Abbildung auf der nächsten Seite (Abbildung 2) zusammen und stellen Sie sicher, dass es keine Luftblasen zwischen den Schichten gibt.Tragen Sie halbtrockene oder nasse Transfersysteme gemäß den Anweisungen des Herstellers des Blottinggerätes auf.
Immunoblotting
-
Nach dem Transfer die Membran zweimal mit destilliertem Wasser waschen.
-
Markieren Sie die Bänder der MW-Leiter auf der Membran vorsichtig mit einem Bleistift.
-
Wenn gewünscht, färben Sie die Membran 30 Sekunden lang mit handelsüblicher Ponceau-Rot-Lösung, um Proteinbanden sichtbar zu machen und waschen Sie dann die Ponceau-rote Lösung mit einer großzügigen Menge 1x TBST weg.
-
Die freien Bindungsstellen auf der Membran blockieren Sie mit 1 × TBST, welche (2-5%) fettfreie Trockenmilch (oder 1-5% BSA zum Nachweis von Phospho-Epitopen) enthalten, unter konstantem Schütteln für 1 Stunde oder über Nacht bei 4 ° C.
-
Verdünnen Sie den primären Antikörper in der Blockierungslösung. Beginnen Sie mit einem Verdünnungsverhältnis von 1: 1000. (Optimale Verdünnungen sollten experimentell mit einer Verdünnungsreihe bestimmt werden.) Inkubieren Sie die Membran mit dem primären Antikörper für 1 Stunde (oder über Nacht bei 4 ° C) auf einem Schüttler.
-
Waschen Sie die Membran dreimal mit 1x TBST für jeweils 10 Minuten.
-
Inkubieren Sie die Membran mit einem geeigneten HRP-konjugierten sekundären Antikörper (der die Wirtsspezies des primären Antikörpers erkennt), verdünnt gemäß den Anweisungen. Inkubieren Sie für 1 Stunde mit konstantem Schaukeln.
-
Waschen Sie die Membran dreimal mit 1x TBST für jeweils 10 Minuten.
| Tipp: Lassen Sie die Membran während Blotting-Prozesses nicht trocknen. |
Signalerkennung
-
Bereiten Sie das ECL-Substrat gemäß den Vorgaben des Herstellers vor.
-
Inkubieren Sie die Membran für 1 bis 5 Minuten vollständig mit dem Substrat (Zeit für empfindlichere ECL-Substrate anpassen, z. B. SuperSignal West Femto Chemiluminescent Substrate [Pierce]).
-
Die Membran einem Autoradiographiefilm in einer Dunkelkammer aussetzen oder mit einem Chemilumineszenz-Bildgebungssystem lesen.
-
Richten Sie den entwickelten Film in der korrekten Ausrichtung auf den Blot aus und markieren Sie die Bänder der MW-Leiter direkt auf dem Film. Es empfiehlt sich zusätzliche Notizen wie den Inhalt der Spur, die Filmbelichtungszeit und die ECL-Eigenschaften hinzuzufügen.
Signalerkennung
-
Bereiten Sie das ECL-Substrat gemäß den Vorgaben des Herstellers vor.
-
Inkubieren Sie die Membran für 1 bis 5 Minuten vollständig mit dem Substrat (Zeit für empfindlichere ECL-Substrate anpassen, z. B. SuperSignal West Femto Chemiluminescent Substrate [Pierce]).
-
Die Membran einem Autoradiographiefilm in einer Dunkelkammer aussetzen oder mit einem Chemilumineszenz-Bildgebungssystem lesen.
-
Richten Sie den entwickelten Film in der korrekten Ausrichtung auf den Blot aus und markieren Sie die Bänder der MW-Leiter direkt auf dem Film. Es empfiehlt sich zusätzliche Notizen wie den Inhalt der Spur, die Filmbelichtungszeit und die ECL-Eigenschaften hinzuzufügen.